「どの病気にどの治療法が用いられるべきか」というのは医療において大きな課題の1つです。これはどのように決められるのでしょうか。
そこで近年重要視されているのが EBM (Evidence-Based Medicine) という考え方です。
エビデンス (Evidence) とはある治療法が推奨されるだけの科学的根拠・証拠のことです。
EBM とは日本語で言うと「科学的根拠に基づいた医療」となります。
これは必ずしも「論文があるから正しい!」ということではなく、論文の信頼性などをしっかりと考え、目の前にいる患者さんにその治療法を当てはめることができるかどうかなどを総合的に考えて医療を行うことを言います。
つまり、EBM とはその時点で最も適切だと考えられる科学的根拠/実証報告をもとに、それが目の前の患者さんに適応できるかどうかを考え、患者さんの価値観や希望と医療者の技能を考え合わせ、よりよい医療を目指すことなのです。
ここで注意していただきたいのは、EBM とエビデンスは同じではないということです。EBM とは、①患者さん自身の病状や生活環境 (Clinical circumstances) ②現時点での最良のエビデンス (Research evidence) ③患者さんの好み (Patients’ preferences) を統合し、最終的に医師の専門知識を活かして治療を提案する「手法」なのです。そのため、この3つの要素のいずれかが欠けても適切な診療を提供することはできないのです。
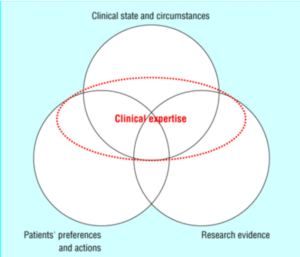
(Haynes RB,et al. Physicians’ and patients’ choices in evidence based practice. BMJ. 2002 Jun 8;324(7350):1350.より引用)
さて、エビデンスには「レベル」、すなわち根拠の強さが存在します。
これは、研究から得られた結果や意見を他の患者さんに適応して問題ないか、という指標であり、主に研究デザインによって異なります。
エビデンスレベルを高いものから並べたものが以下の表になります。
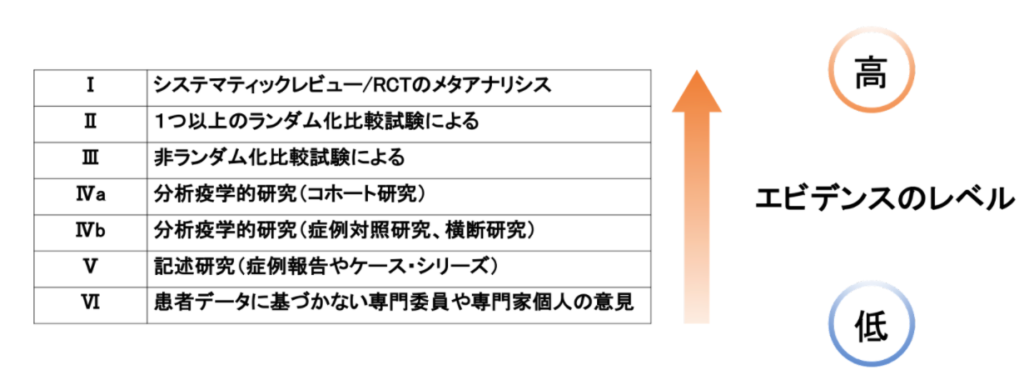
あくまでこの表は研究手法そのものの評価であって、研究の内容によって質は大きく変わります。それを評価するには専門的な知識が必要で、ここが専門家の腕の見せ所といえます。
EBMの実践は非常に骨の折れることなのです。
診療ガイドライン
公益財団法人 日本医療機能評価機構 (Minds) では診療ガイドラインを次のように定義しています。
Minds による診療ガイドラインの定義 (参考文献1 )
健康に関する重要な課題について、医療利用者と提供者の意思決定を支援するために、システマティックレビューによりエビデンス総体を評価し、益と害のバランスを勘案して、最適と考えられる推奨を提示する文書。
少し難しいので簡単に言うと「ある病気に対して今までに報告された研究を調べてまとめて効果が高く副作用が少ない治療法を書いたもの」を指します。ガイドラインは現状考えられる診断方法や治療が根拠とともに書かれている診療に欠かせない文書です。どのような病気に対しても、まずはこのガイドラインに従って診療が行われるのが一般的にはよいです。
しかし、何らかの理由がある場合、ガイドラインから外れた診療が行われることもあります。
代表的なものは患者さんの状況によりガイドライン通りの治療ができない場合などが考えられます。例えば腎臓や肝臓の機能が悪くてガイドラインに書かれている薬を使うことができない場合があります。その他にも、患者さんの希望などによってガイドライン上にない治療が行われることもあります。
他には、ガイドライン作成後に新しい治療法が開発された場合です。
ガイドラインは必ずしも毎年改訂されるわけではなく、例えば抗がん剤など日進月歩の分野では次のガイドラインができるまでの間に新しく薬が承認されることがしばしばあります。この場合はもちろんガイドラインに載っている治療法のみに固執せず、効果と副作用を天秤にかけ、患者さんにとって最も良いと思われるものを選びます。
このように、日常診療では必ずしも診療ガイドライン通りに行われるわけではありません。
しかしそれでもなお、治療選択において診療ガイドラインが重要であることに間違いはありません。
最善の治療を行うためには、ガイドラインを参考にしながら患者さんと主治医はよく話し合い、治療方針を決めていく必要があります。
国内の質の高いガイドラインは Minds に収載されているので、ここで公開されているガイドラインがないかどうかチェックしてみると参考になるかもしれません。
システマティックレビュー・メタアナリシス
システマティックレビュー (SR: systematic review) とは「数多くの研究結果を網羅的・体系的に集め、その時点での結果をまとめたもの」であり、メタアナリシス (meta-analysis) とは「集めた複数の研究結果を統計学的手法を用いて統合したもの」です。
これだけだとよくわかりませんね。おおまかに言うと、多くの研究結果を集めて分析したものをシステマティックレビューと呼び、その中でそれらの結果を統計的に統合して評価したものがメタアナリシス、ということになります。
例としてコーヒーと糖尿病の関連について調べたメタアナリシスを見ていきましょう (参考文献 2)。
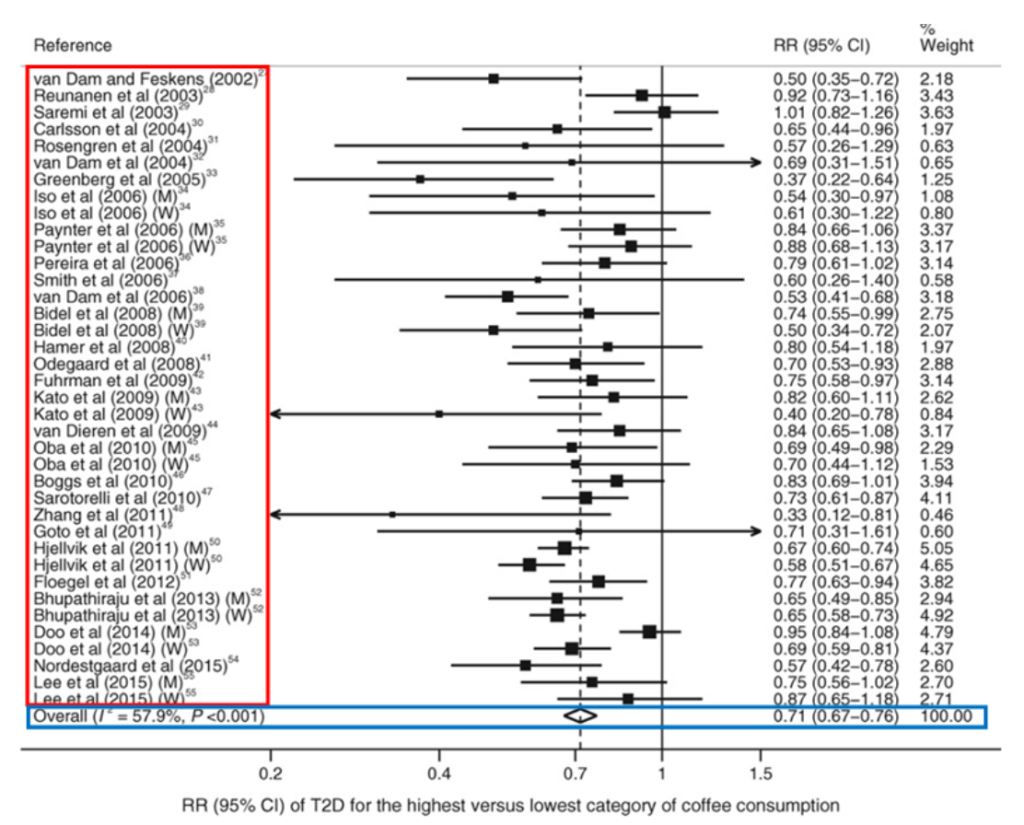
(Carlström M, Larsson SC. Coffee consumption and reduced risk of developing type 2 diabetes: a systematic review with meta-analysis. Nutr Rev 2018; 76(6): 395-417. Figure 2 を改変)
赤い線で囲った部分はこのメタアナリシスで集めた論文の著者と発表された年です。その右にある矢印がそれぞれの論文で報告された「コーヒーの摂取と糖尿病発症リスク」の関係を表します。
少し難しい話ですが、この矢印の範囲が研究におけるコーヒー摂取による糖尿病発症リスクを表しています。詳しく説明すると、1を超えていると「コーヒーを摂取すると糖尿病が増える」1を下回っていると「コーヒーを摂取すると糖尿病が減る」ということを表しています。
しかし、多くの研究でこの矢印が1をまたいでいることから、かたやコーヒーを摂取すると糖尿病が減り、かたやコーヒーを摂取すると糖尿病が増える可能性がある、という何とも言えない結果になっています。
メタアナリシスはこのような研究をあわせて解析することでより信頼性の高い結果を導く手法です。青く囲った部分は複数の研究結果を統合した結果であり、この場合はひし形マークが1よりもしたの 0.7 付近になっているので「コーヒーを摂取している人とは摂取しない人に比べて糖尿病の発症リスクが0.7倍になった」、と解釈することができます。
システマティックレビューやメタアナリシスは複数の研究を統合して結論を出していくので、そのエビデンスレベルは高いとされています。一つの研究でしか示されていない結論より、数多くの研究結果を合わせて出したものの方が信頼性が高い、というのは感覚的にもわかりやすいかと思います。
しかし、システマティックレビューやメタアナリシスの信頼性は集める研究の質に左右されます。そもそもの研究に不正があったり、不適切な部分があったりすると、いくら集めても信頼性の低いものしかできません。
また、これらの手法は「網羅的に検索する」ことが重要です。例えば、ある治療薬の効果を知りたい際に、意図的に論文を選んでしまうと信頼性は落ちてしまいます。
システマティックレビューやメタアナリシスを評価する際は、これらの点に注意する必要があります。
ランダム化比較試験 (RCT: randomized controlled trial)
臨床試験や治験などで研究の参加者を新しい治療や薬の投与などを行う「介入群」とそれを行わない「対照群」にランダムに割りふって結果を観察する研究のことをランダム化比較試験といいます。介入の効果を明らかにするためには優れた研究方法であるとされ、エビデンスレベルの高い手法です。
RCT は典型的には下の図のように行われます。プラセボとは、見た目は薬だけれど薬の効果のない偽の薬のことです。状況に応じて、プラセボの代わりに今までの治療に用いられていた薬を用いる場合もあります。
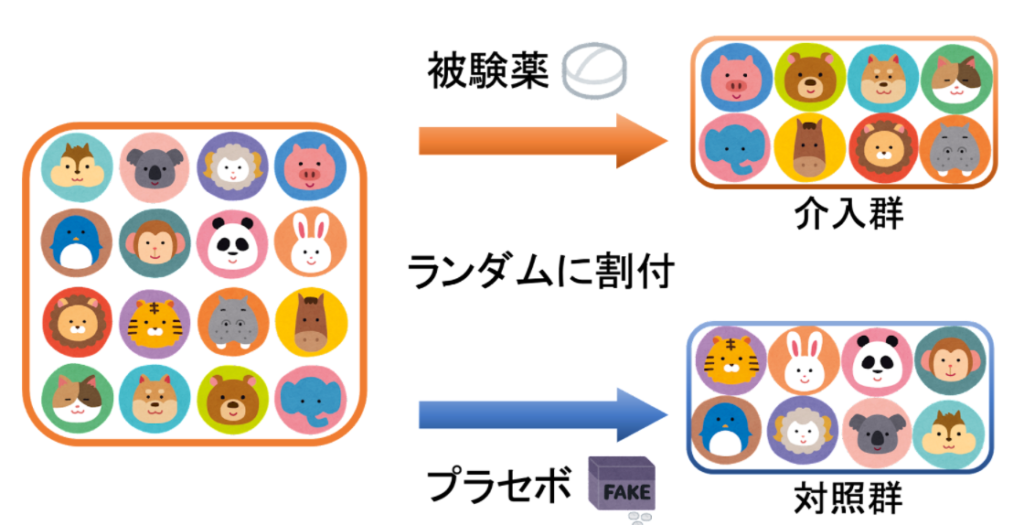
どうしてこんなに面倒な手順を踏まないといけないのでしょうか。
これはきちんと薬の効果を調べるためには①プラセボ効果の除外②患者さんの背景を合わせる、この2点が必要になるためです。
なんとも難しい話になってきました。これを理解するために血圧をさげる薬を例に考えてみましょう。
①プラセボ効果の除外
「この薬を投与した50人で、薬を飲む前よりも飲んだ後のほうが血圧がさがりました」
これだけ読むと、この薬に効果があるように感じられませんか。しかし、これは医学的には全く正しくない解釈なのです。
薬を飲むと血圧が下がった、といいますが、それは本当に薬の効果なのでしょうか。もしかしたら「何かを飲む」という行為自体で血圧が下がっている可能性も否定できません。
実際に医学の分野ではこのように見た目は薬だけれど有効成分が一切入っていない「プラセボ」という偽の薬を飲んでも状態の改善が見られることが驚くほど多く、これを「プラセボ効果」と呼びます。
したがって、本当に薬を飲んでの効果なのか、それともプラセボ効果なのかを判定するために、薬を飲んだ人たちと、プラセボを飲んだ人たちを比べて本当に血圧が下がっているのかを調べる必要があるわけですね。
②患者さんの背景を合わせる
プラセボ効果についてはなんとなく理解していただけたでしょうか。では次のような例はどうでしょうか。
「薬を投与した人50人と、プラセボを投与した50人を比較して、薬を飲んだ人のほうが血圧がさがりました」
これはなんだか良さそうな気がしませんか?しかし、これでも医学的にはまだ不十分な研究なのです。
薬を投与した50人、といいますが、その人達はどのような人達だったのでしょうか。もしかしたら薬を投与した人たちの年齢は30歳くらいで、プラセボを投与した人たちの年齢は60歳くらいかもしれません。あるいは、薬を投与した人たちは運動も減塩も頑張っていたかもしれません。
このように、薬を投与する人たちとプラセボを投与する人たちの背景 (年齢、今までの病気、生活習慣など) を合わせるために行われるのが RCT (randomoized controlled trial) です。
100人の高血圧の患者さんを集め、50人には薬を投与、別の50人にはプラセボを投与するとしましょう (なお、本来集める患者さんの数は調べている薬の予想される効果によって統計学的に算出されます) 。
この際、患者さんの背景をきちんと揃えるためにコンピュータなどを用いて完全にランダムに2つの群に振り分けます。
これをすることによって、片方のグループには若い人だけ、減塩などもしっかりした人だけなどの偏りを防ぐことができ、薬を投与された群とプラセボを投与された群の背景を揃えることができるのです。
このように、ランダム化比較試験は「プラセボとの効果の比較」と「ランダム化」によって、対象の薬が本当に効果があるのかを調べる手法なのです。
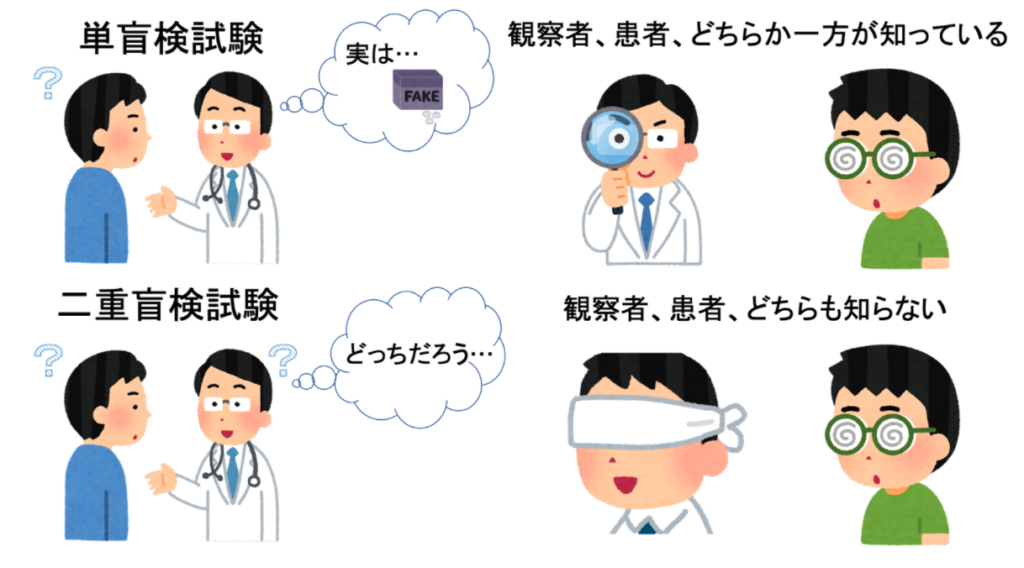
二重盲検試験
医薬品を承認するために必要な治験ではこのランダム化比較試験 (RCT) と二重盲検試験 (ダブルブラインドテスト) を組み合わせて実施されることが多いです。
二重盲検試験(ダブルブラインドテスト)とは、患者さんと薬を投与している医師のどちらも被験薬を投与しているのかそれともプラセボを投与しているのかわからない状態を作り出し試験する方法をいいます。ここでいう被験薬とは、効果を調べたい薬剤のことをいいます。
なぜそのようなめんどうな手順をわざわざ踏むのでしょうか。
それは、投与した薬が被験薬かどうかを医師側・患者側どちらかでも知っていることによって、質の高い研究を行うことができなくなってしまう可能性があるからです。
例えば、痛み止めの治験を行うとします。患者さんが自分の飲んでいる薬がプラセボだと知っていた場合、プラセボ効果が通常よりも小さくなるといった影響が考えられます。逆に、自分の飲んでいる薬が本物の痛み止めと知っていた場合、本来より痛くないように感じるといった影響が考えられます。そうなってしまうと、薬の効果を正確に判定することが難しくなってしまいます。そこで、治験の参加者にこの情報を隠す事によって、これらの影響を少なくすることができます。
また、観察者 (医師や治験の管理者など) が被験薬、プラセボのどちらを服用しているのか知っていると「観察者バイアス」とよばれる偏りが生じる可能性があります。観察者バイアスとは、医師など治験を行ったりデータを分析したりする観察者が被験薬を投与している対象を知っていることによって効果を判定する際に無意識に評価を高く見積もってしまったり積極的な治療をしてしまうことによって生じます。このように、RCT を行う上で医師も患者もプラセボか被験薬かわからないようにするのが理想的です。しかし、状況によっては難しい場合もあるので、どちらか一方だけわからないようにする単盲検試験という手法が取られる場合もあります。